Vedeli ste o reakcii Svätého grálu v chémii?
2024,04,22
Pokiaľ ide o zemný plyn, nesmiete s ním nie sú oboznámení a v súčasnosti bez neho nemôže uvariť žiadna domácnosť. Hlavnou zložkou zemného plynu je metán, ktorý je jednou z najjednoduchších uhľovodíkových zlúčenín. Zrýchlenie rozvoja a využívania metánu je kľúčom k realizácii zeleného a trvalo udržateľného rozvoja energetického a chemického priemyslu. Okrem priameho použitia ako paliva sa môže metán používať aj ako zdroj C1, tj molekula, ktorá obsahuje atóm uhlíka a môže sa naďalej premieňať na prípravu chemikálií s vysokou pridanou hodnotou, ako je metanol, formický kyselina a tak ďalej. Metán sa môže spáliť v kyslíku za vzniku vody a oxidu uhličitého. Je bez spaľovania možné aktivovať a prevádzať uhľovodíkové väzby molekúl metánu za miernych podmienok? Odpoveď je áno! Toto je reakcia „Svätého grálu“ v oblasti katalýzy. Reakcie spojené s „svätým grálom“ sú často mimoriadne náročné, pretože možno bude potrebné vykonať za veľmi drsných podmienok, alebo možno bude potrebné prekonať prirodzené ťažkosti chemickej reakcie, ako je aktivácia vysoko stabilných zlúčenín, nízka výnosy a nízka selektivita. Tieto výzvy sťažujú realizáciu týchto reakcií, ale ak sa dajú úspešne dosiahnuť, povedú k významným prielomom vo vedeckom výskume a priemyselných aplikáciách.

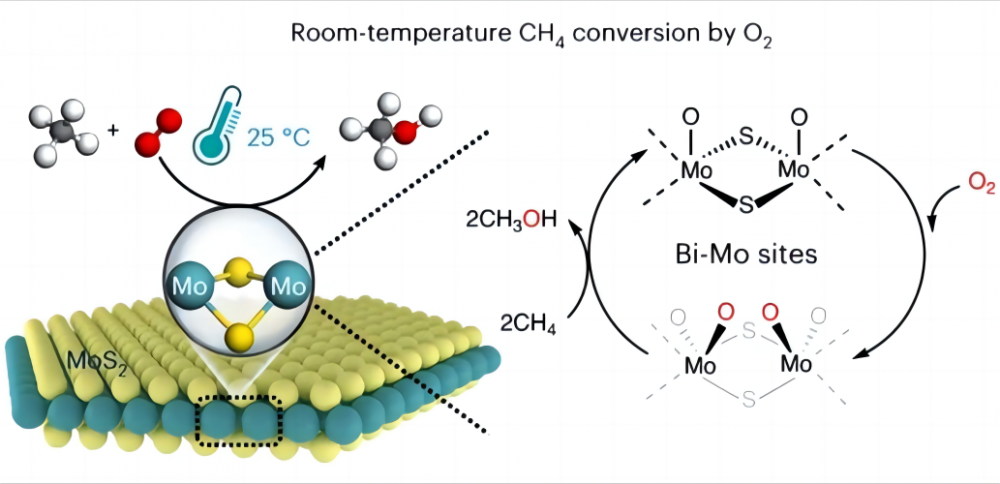
1. Pri premene metánu pri nízkych teplotách Je veľmi ťažké previesť metán priamo na ďalšie užitočné chemikálie s lacným kyslíkom pri nízkych teplotách alebo dokonca na teplotu miestnosti, prečo je to tak? Pozrime sa na povahu metánu a kyslíka. Chemická štruktúra metánu obsahuje štyri identické väzby uhlíka-hydrogén (CH), ktoré tvoria vysoko symetrickú ortotetrohedrálnu konfiguráciu, a každá väzba CH3-H metánu má väzbu do 435 kJ/mol. Môžeme považovať väzbu metánu CH ako obzvlášť silnú jar. Táto jar je veľmi napnutá a vyžaduje si natiahnutie veľkej sily. V chémii je táto „sila“ energia potrebná na prelomenie väzby CH. Vďaka tejto vysokej väzbovej energii je metánove väzby CH termodynamicky stabilné a za normálnych podmienok je veľmi ťažké rozbiť alebo reagovať. Na druhej strane, v chemických reakciách sa reaktívne skupiny zvyčajne vytvárajú pri polárnej interakcii (polárna interakcia je jav, ktorý má molekula jeden koniec pozitívne nabitý a druhý nabitý), zatiaľ čo symetrická štruktúra a nepolárna povaha molekuly metánu sa bráni Z generovania takejto polarity (podľa molekulárnej konfigurácie molekula s rovinou symetrie nemá polaritu) a nemôže poskytovať reaktívne skupiny. Preto je aktivácia a premena metánu veľmi náročné a zvyčajne si vyžaduje tvrdé podmienky, ako sú vysoké teploty (600-1100 ° C) alebo niektoré „extrémofily“, ako sú super silné kyseliny a voľné radikály, ktoré pomáhajú pri aktivácii metánu. Preto hlavné ťažkosti s realizáciou nízkej teploty aktivácie metánu a kyslíka spočívajú v tom, ako aktivovať CH väzbu metánu, tj, ako natiahnuť „pružinu“ v väzbe CH. 2. Zázrak katalyzátora Vedci prišli s dobrým riešením tohto problému a rozhodli sa použiť katalyzátor na pomoc pri aktivácii metánu pri nízkych teplotách (katalyzátor je chemikália, ktorá sa nezmení pred alebo po reakcii, ale zrýchľuje reakciu zmenou minimálneho množstva energie, ktorú je potrebné vstreknúť na reakciu). V roku 2023 katalýza v časopise Nature uviedla o procese dosiahnutia priamej premeny metánu s kyslíkom na oxidy C1 (metanol (CH3OH), kyselina mravčová (HCOOH) a metylénglykol (Hoch2OH)) s použitím špecifického disulfidu molybdénu (MOS2) katalyzátor pri 25 ° C. Konverzia metánu 4,2% a takmer 100% kyslíkov C1 sa dosiahla premenou metánu a kyslíka na cenné kyslíky C1 za okolitých podmienok. Tento MOS2 je doteraz hlásený jediným katalyzátorom, ktorý dokáže realizovať premenu metánu a kyslíka v miestnosti. Je to všetko kvôli jedinečnej geometrii a elektronickej štruktúre miesta MO na okraji MOS2. Toto miesto MO má vysokú aktivačnú aktivitu voči kyslíku vo vodnom prostredí a tvorí magický druh O = MO = o*. Tento druh uľahčuje zlomenie väzby uhlíka a vodíka a znižuje aktivačnú energiu CH väzby metánu, čím sa výrazne zvyšuje reaktivita metánu, a tým realizuje nízku teplotu aktivácie metánu a kyslíka. Tento objav prinesie viac možností pre budúce využitie energie a ochranu životného prostredia, ako aj nám poskytne hlbšie pochopenie úžasnej úlohy katalyzátorov a pomocných pomocníkov.
3. Výrobný strategický význam aktivácie metánu s nízkou teplotou Realizácia priamej katalytickej konverzie metánu a kyslíka pri izbovej teplote a premena metánu v zemnom plyne na ďalšie užitočné chemikálie môže výrazne zlepšiť mieru využívania zemného plynu, znížiť odpad a lepšie chrániť životné prostredie a realizovať trvalo udržateľný rozvoj energie . Po druhé, ako skleníkový plyn je metán na druhom mieste iba oxidu uhličitého v príspevku k globálnemu otepľovaniu. Ak sa metán môže previesť na iné látky, môže nám pomôcť znížiť emisie znečisťujúcich látok (napr. Oxidy uhlíka, oxidy dusíka, oxidy síry, uhľovodíky a zlúčeniny éteru) a zmierniť tlak globálneho otepľovania.




